Acide tétrahydrofolique
Dans le monde d'aujourd'hui, Acide tétrahydrofolique reste un sujet d'intérêt et de débat constant. Au fil du temps, sa pertinence s’est accrue et a touché différents secteurs de la société. Du niveau personnel au niveau professionnel, Acide tétrahydrofolique s’est avéré être un point crucial qu’on ne peut ignorer. Son influence s’est étendue aux quatre coins du monde, touchant des personnes de tous âges, de toutes cultures et de toutes conditions. Dans cet article, nous explorerons en détail les différentes facettes de Acide tétrahydrofolique et comment elle a façonné et continue de façonner notre réalité.
| Acide tétrahydrofolique | |
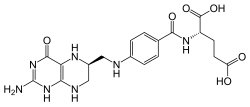 Structure de l'acide tétrahydrofolique |
|
| Identification | |
|---|---|
| Synonymes |
acide 5,6,7,8-tétrahydrofolique |
| No CAS | |
| No CE | 205-181-1 |
| PubChem | 1129 |
| ChEBI | 20506 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C19H23N7O6 [Isomères] |
| Masse molaire[1] | 445,429 2 ± 0,02 g/mol C 51,23 %, H 5,2 %, N 22,01 %, O 21,55 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L’acide tétrahydrofolique, couramment abrégé en THFA ou H4FA dans la littérature anglophone, est une coenzyme dérivée de l'acide folique, ou vitamine B9, qui intervient dans un grand nombre de réactions biochimiques, notamment dans le métabolisme des acides aminés et des acides nucléiques (en particulier des purines), comme activateur de groupes monocarbonés destinés à ces réactions de biosynthèse. Sa forme biologiquement active est sa base conjuguée, l'anion tétrahydrofolate.
Le tétrahydrofolate est produit par la dihydrofolate réductase à partir du dihydrofolate. Le méthotrexate, qui inhibe cette enzyme, est un poison cellulaire efficace bloquant la synthèse des nucléotides et est utilisé en chimiothérapie. La sérine hydroxyméthyltransférase (EC ) convertit le tétrahydrofolate en 5,10-méthylènetétrahydrofolate.
Structure
La molécule est composé d'une unité ptéridine substituée, d'un p-aminobenzoate et d'un ou de plusieurs résidus glutamiques[2].
Notes et références
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ Jeremy Mark Berg, John L. Tymoczko, Lubert Stryer et Gregory Joseph Gatto, Biochimie, Médecine-sciences publications-, (ISBN 978-2-257-20427-1), p. 715
Liens externes
- (en) University of Massachusetts Medical School « Folic Acid Metabolism ».