Naphtalène
| Naphtalène | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  Structure du naphtalène. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identification | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nom UICPA | naphtalène | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom systématique | bicyclodéca-1,3,5,7,9-pentène | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Synonymes |
naphtaline |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No CAS | 91-20-3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No ECHA | 100.001.863 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No CE | 202-049-5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | 931 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SMILES | C1=C2C(=CC=C1)C=CC=C2 PubChem, vue 3D |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI | InChI : vue 3D InChI=1S/C10H8/c1-2-6-10-8-4-3-7-9(10)5-1/h1-8H InChIKey : UFWIBTONFRDIAS-UHFFFAOYSA-N |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | Cristaux incolores rhomboédriques sous forme d'écailles. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés chimiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Formule | C10H8 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse molaire | 128,170 5 ± 0,008 6 g/mol C 93,71 %, H 6,29 %, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Susceptibilité magnétique | χ M {\displaystyle \chi _{M}} 91,9×10-6 cm3·mol-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T° fusion | 80,2 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T° ébullition | 217,96 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solubilité | 32 mg·l-1 eau à 20 °C. Sol dans éthanol, éther, benzène, chloroforme, acide acétique, acide chlorhydrique, et dans les huiles |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Paramètre de solubilité δ | 20,3 MPa1/2 (25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse volumique | 1,162 g·cm-3 (20 °C)
équation :
ρ
=
0.61674
/
0.25473
(
1
+
(
1
−
T
/
748.35
)
0.27355
)
{\displaystyle \rho =0.61674/0.25473^{(1+(1-T/748.35)^{0.27355})}}
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T° d'auto-inflammation | 567 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d’éclair | 79 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Limites d’explosivité dans l’air | 0,9–5,9 %vol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pression de vapeur saturante | à 25 °C : 11 Pa
équation :
P
v
s
=
e
x
p
(
62.447
+
−
8109
T
+
(
−
5.5571
)
×
l
n
(
T
)
+
(
2.0800
E
−
18
)
×
T
6
)
{\displaystyle P_{vs}=exp(62.447+{\frac {-8109}{T}}+(-5.5571)\times ln(T)+(2.0800E-18)\times T^{6})}
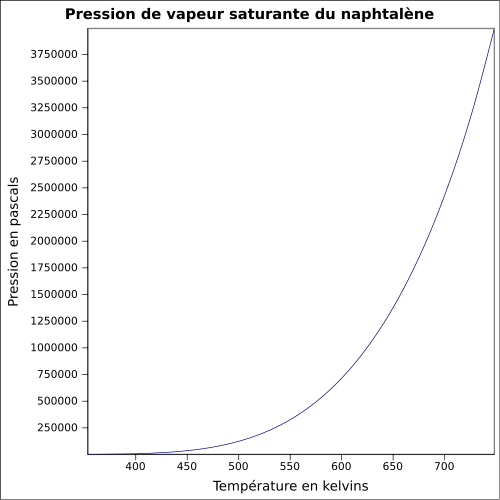
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point critique | 475,2 °C , | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point triple | 80,28 °C, 999,6 Pa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermochimie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cp |
équation :
C
P
=
(
2.9800
E
4
)
+
(
527.50
)
×
T
{\displaystyle C_{P}=(2.9800E4)+(527.50)\times T}
équation :
C
P
=
(
67.099
)
+
(
4.3239
E
−
2
)
×
T
+
(
9.1740
E
−
4
)
×
T
2
+
(
−
1.0019
E
−
6
)
×
T
3
+
(
3.0896
E
−
10
)
×
T
4
{\displaystyle C_{P}=(67.099)+(4.3239E-2)\times T+(9.1740E-4)\times T^{2}+(-1.0019E-6)\times T^{3}+(3.0896E-10)\times T^{4}}
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PCS | 5 156,3 kJ·mol-1 (25 °C, solide) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cristallographie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Système cristallin | monoclinique | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Classe cristalline ou groupe d’espace | P 2 1 / a {\displaystyle P2_{1}/a} | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Paramètres de maille | a = 8,24 Å |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés optiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Indice de réfraction | n 100 {\displaystyle n_{}^{100}} 1,582 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Précautions | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH, | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   AttentionH302, H351, H410, P273, P281 et P501H302 : Nocif en cas d'ingestion H351 : Susceptible de provoquer le cancer (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger) H410 : Très toxique pour les organismes aquatiques, entraîne des effets à long terme P273 : Éviter le rejet dans l’environnement. P281 : Utiliser l’équipement de protection individuel requis. P501 : Éliminer le contenu/récipient dans … |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SIMDUT | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  B4, D2A, B4 : Solide inflammable Transport des marchandises dangereuses : classe 4.1 D2A : Matière très toxique ayant d'autres effets toxiques cancérogénicité : CIRC groupe 2B Divulgation à 0,1 % selon les critères de classification |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 220 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Transport | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
40 : matière solide inflammable ou matière autoréactive ou matière autoéchauffante Numéro ONU : 1334 : NAPHTALÈNE BRUT ; ou NAPHTALÈNE RAFFINÉ Classe : 4.1 Code de classification : F1 : Matières solides inflammables, sans danger subsidiaire, organiques ; Étiquette :  4.1 : Matières solides inflammables, matières autoréactives, matières solides explosibles désensibilisées et matières qui polymérisent Emballage : Groupe d'emballage III : matières faiblement dangereuses.
44 : matière solide inflammable qui, à une température élevée, se trouve à l'état fondu Numéro ONU : 2304 : NAPHTALÈNE FONDU Classe : 4.1 Code de classification : F2 : Matières solides inflammables, sans danger subsidiaire, organiques, fondues ; Étiquette :  4.1 : Matières solides inflammables, matières autoréactives, matières solides explosibles désensibilisées et matières qui polymérisent Emballage : Groupe d'emballage III : matières faiblement dangereuses. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Classification du CIRC | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe 2B : Peut-être cancérogène pour l'homme | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Écotoxicologie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LogP | 3,3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Seuil de l’odorat | bas : 0,009 5 ppm haut : 0,64 ppm |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Composés apparentés | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isomère(s) | Azulène | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unités du SI et CNTP, sauf indication contraire. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| modifier |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Le naphtalène ou naphtaline ou camphre de goudron est un hydrocarbure aromatique polycyclique, plus précisément un alcène à deux cycles, de formule brute C10H8. Son odeur caractéristique est perceptible par l'odorat humain à partir de 0,04 ppm. Il a été couramment utilisé comme antimites. On a constaté par le suivi des maladies des travailleurs de l'industrie chimique qu'il était possiblement cancérigène,.
Origine et fabrication
Le naphtalène a été isolé en 1820 par Garden (1784-1866). Sa représentation actuelle sous la forme de deux noyaux aromatiques est proposée par Erlenmeyer en 1868.
En Allemagne, la matière première utilisée pour la production de naphtalène est le goudron de houille, qui en contient environ 10 %. La production de coke étant en régression, on utilise de plus en plus des produits dérivés du pétrole (essence de pyrolyse, huiles résiduelles de pyrolyse) ; fabrication par distillation fractionnée.
La teneur en naphtalène dans le produit technique est 95 % au moins, le reste étant constitué d'impuretés telles que les benzo(b)thiophènes (thionaphtènes) et, pour les naphtalènes issus du pétrole, exclusivement de méthylindènes.
Usages
 Des boules de naphtalène utilisées contre les mites aux Philippines.
Des boules de naphtalène utilisées contre les mites aux Philippines.
Le naphtalène était autrefois surtout utilisé comme répulsif contre les mites (on a aussi utilisé le paradichlorobenzène pour cet usage). Aujourd'hui, 60 % du naphtalène produit est vendu comme produit chimique intermédiaire dans la fabrication d'anhydride phtalique, selon l'INERIS. Cet anhydride phtalique sert à synthétiser les phtalates et divers agents plastifiants, résines, teintures, insecticides ou répulsifs, etc. Il est aussi employé comme agent de tannage du cuir et dans certains tensioactifs (sulfonates de naphtalène et dérivés ayant fonction d'agents dispersants ou mouillants en peinture, teinture, formulation de papier d'emballage, dans la fabrication du béton et de plaques de plâtre).
Le napalm, notablement utilisé lors de la guerre du Viêt Nam, était initialement obtenu à partir de naphtalène (d'où le « na ») et d'acide palmitique (d'où le « palm »). Le naphtalène est d'ailleurs utilisé pour obtenir des effets pyrotechniques, l'explosion produisant une fumée très noire.
Il peut être utilisé pour fabriquer certains plastiques (notamment en synthétisant des phtalates), des colorants... mais aussi pour d'autres applications, plus marginales : antiseptique, microbicide, diélectrique, parfums...
Dans l'environnement
Une espèce de termite américain Coptotermes formosanus sécrète de petites quantités de naphtalène pour lutter contre des parasites et son principal prédateur, la fourmi Solenopsis invicta, mais l'essentiel du naphtalène présent dans la nature (89 % environ selon l'INERIS) vient de combustions incomplètes (pyrolyse) (chauffage domestique au bois) et de la sublimation du naphtalène utilisé comme insecticide. Environ 10 % des émissions dans l'air viendraient de la distillation du charbon. La fumée de tabac en contient de petites quantités.
Le naphtalène étant volatil (par sublimation) il s'y disperse rapidement. Le taux moyen dans l'air serait de 1 µg m−3, soit bien plus que dans l'eau de mer où il est peu soluble (10 ng l−1) et d'où il peut dégazer dans l'air (idem pour l'eau douce). Les sols (2 µg kg−1 en moyenne) le retiennent mal (dégazage, adsorption moyenne). Il est habituellement peu présent dans les sédiments (2 µg kg−1). Les essais d’adsorption/désorption répertoriés par l'INERIS donnent des Koc de 378 à 3 200 L kg−1,,. La Commission européenne (CE, 1996) a retenu une valeur de 1 320 L kg−1.
Bioaccumulation
Ses effets écotoxicologiques sont mal connus, mais il a été montré qu'il est bioaccumulable chez plusieurs espèces de poissons (ex : Cyprinus carpio, Pimephales promelas), moules (Mytilus edulis) et huîtres (Ostrea edulis).
Le naphtalène semble pouvoir être absorbé par les racines et feuilles des plantes, mais l'INERIS en 2005 n'a pas trouvé d'études sur ses effets ni sur d'éventuels facteurs de bioconcentration.
Dégradation
Compte tenu de sa structure chimique le naphtalène est réputé très stable.
Il semble très peu biodégradable en conditions normales. Un test standard n'a montré que 2 % de dégradation après 28 jours, mais des tests (non normalisés) laissent penser qu'il peut être rapidement biodégradé en conditions aérobies et dénitrifiantes lorsque mis en contact avec certains micro-organismes qui le font quasiment disparaître en 8 à 12 jours dans les meilleurs cas,,.
La Commission européenne (CE, 1996) a retenu une demi-vie de 150 jours dans les eaux de surface. Quelques tests (non normalisés) de biodégradéation en condition anaérobie et notamment dans les sédiments, laissent penser qu'il est stable dans ces conditions.
Toxicologie
Divers rapports de l'ATSDR (1995) et de l'Environmental Protection Agency aux États-Unis (1998) ont mis en avant plusieurs caractéristiques toxicologiques de ce produit (voir aussi le rapport INERIS « Hydrocarbures Aromatiques Polycycliques (HAPs) : Évaluation de la relation dose-réponse pour des effets cancérigènes - Approche substance par substance. Ils estiment que le naphtalène peut être absorbé et dans certains cas provoquer un empoisonnement via les tractus respiratoire et digestif ainsi qu'au travers de la peau en contact avec des draps ou vêtements traités par un anti-mite, notamment chez le nouveau-né. Dans l'organisme humain, on connait au moins deux métabolites stables du naphtalène ; le 1-naphtol et le 1,2-dihydro naphtalène diol. Selon l'INERIS, le naphtalène peut être méthylé en 1-méthylnaphatlène (peut-être moins toxique que le naphtalène) ou en 2-méthylnaphatlène. Il est majoritairement peu à peu éliminé en métabolites via les urines.
Les enfants sont plus sensibles à cette molécule. Les individus d’origine africaine et asiatique y sont plus sensibles en raison d'une déficience plus fréquente de l’enzyme G6PD.
Sources d'exposition des organismes vivants
- Pétrochimie ;
- incendies de bâtiments ;
- fumée de tabac ;
- échappement de moteur à combustion ;
- émissions dues au chauffage ;
- émanations de plastifiants ;
- émanations de résines ;
- émanations de teintures ;
- émanations de certains emballages ;
- émanations de répulsifs insecticides (ex: antimites) ;
- émanations de sols pollués (avec des taux parfois élevés) ;
- ...
Effet sur la santé
L'inhalation serait la première source d'exposition selon l'AFSSET qui notait en 2010 qu'on ne dispose que de rares données d'exposition (Ex : 7 % de 555 logements allemands étudiés de 2003 à 2006 avaient un taux de naphtalène dans l'air dépassant la limite de quantification (1 μg·m-3), sans toutefois dépasser 4,9 μg·m-3) .
- Le naphtalène est classé en tant que substance cancérogène de catégorie 3 par l’Union Européenne, et dans le groupe 2B par le Centre international de recherche sur le cancer (CIRC). L'AFSSET n'a pas trouvé d'informations sur la relation dose-effet et estime que « les données humaines ne sont pas suffisantes pour établir un lien causal entre l’exposition au naphtalène et la survenue de cancer », mais que chez l’animal, l'incidence des adénomes de l’épithélium respiratoire et des neuroblastomes de l’épithélium olfactif (tumeur très rare) augmentent à la suite d'une exposition à ce gaz, ces données n'étant toutefois « pas en l’état transposables à l’Homme » .
- Selon les expériences in vivo et in vitro, le naphtalène n'est pas génotoxique
Symptômes possibles ;
- anémie, quelles que soient les voies d’exposition (et avec des cas documentés d'anémies hémolytiques ayant entraîné la mort, et accompagnée d'un ictère chez le nouveau-né, y compris contaminé in utero, le placenta ne faisant pas barrière à cette molécule)
- hémorragies,
- coagulum
- cataracte (exposition professionnelle)
- voire des hallucinations.
Valeurs seuil, valeur guide
Selon l'AFSSET, avant 2010, il n'y avait pas de valeurs de références existantes (VG et VTR)
- Pas de VG (Valeur Guide), ni de VTR (Valeur Toxicologique de Référence) pour le naphtalène en cas d'exposition aiguë ;
- Aucune donnée toxicologique humaine disponible pour des expositions intermédiaires ;
- une valeur guide d'INDEX de 10 μg·m-3, a été produite appuyée sur le seuil d'effets irritants du produit sur les muqueuses nasales.
En France, la VGAI long terme a été fixée par l'AFSSET (valeur pour 2010, à la suite d'une auto-saisine de 2004 de 2010) à : 10 μg·m-3 pour une exposition supérieure à un an
Notes et références
- (en) Hyp J. Dauben, Jr., James D. Wilson et John L. Laity, « Diamagnetic Susceptibility Exaltation in Hydrocarbons », Journal of the American Chemical Society, vol. 91, no 8, 9 avril 1968, p. 1991-1998
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Naphthalene », sur Hazardous Substances Data Bank (consulté le 17 mars 2010).
- (en) Iwona Owczarek et Krystyna Blazej, « Recommended Critical Temperatures. Part II. Aromatic and Cyclic Hydrocarbons », J. Phys. Chem. Ref. Data, vol. 33, no 2, 30 avril 2004, p. 541 (DOI 10.1063/1.1647147)
- (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, 2007, 2e éd., 1076 p. (ISBN 978-0-387-69002-5 et 0-387-69002-6, lire en ligne), p. 294
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, 1997, 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- NAPHTALENE, Fiches internationales de sécurité chimique
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, 2009, 90e éd., 2804 p., relié (ISBN 978-1-4200-9084-0), p. 6-53
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams : Organic Compounds C8 to C28, vol. 3, Huston, Texas, Gulf Pub. Co., 1996, 396 p. (ISBN 0-88415-859-4)
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press, 18 juin 2002, 83e éd., 2664 p. (ISBN 0849304830, présentation en ligne), p. 5-89
- (en) R. B. Campbell, J. M. Robertson et J. Trotter, « The crystal structure of hexacene, and a revision of the crystallographic data for tetracene », Acta Crystallographica, vol. 15, no 5, mars 1962, p. 289-290
- (en) J. G. Speight et Norbert Adolph Lange, Lange's handbook of chemistry, McGraw-Hill, 2005, 16e éd., 1623 p. (ISBN 0-07-143220-5), p. 2.289
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 2B : Peut-être cancérogènes pour l'homme »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), sur monographs.iarc.fr, CIRC, 16 janvier 2009 (consulté le 22 août 2009).
- Numéro index 601-052-00-2 dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- SIGMA-ALDRICH
- « Naphtalène » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- « Naphthalene », sur hazmap.nlm.nih.gov (consulté le 14 novembre 2009).
- Verschueren K. (1996) - Naphtalene. Handbook of Environmental Data on Organic Chemicals. New York, Van Nostrand Reinhold Co. 3rd Ed, pp. 1756-1762.
- Wolf O. (1976) - Cancers in chemical workers in a former naphtalene purification plant. Dt Gesundh Wesen, 31, 996-999
- Wolf O. (1978) - Carcinoma of the larynx in naphtalene purifiers. Z Ges Hyg., 24, 737-739
- Chimiste écossais, ses découvertes ont été mentionnées par Michael Faraday. Membre fondateur de la Pharmaceutical Society et fournisseur en acide gallique du daguerréotypiste Talbot, il avait étudié sous la direction de Friedrich Accum (1769-1838), préparateur d'Humphry Davy à la Royal Institution.
- Article d'Anne Gallus dans "le Monde" du 12 avril 1998
- Source : INERIS, d'après ATSDR (1995) et HSDB (2000)
- Rippen G., Ilgenstein M., Klöpffer W. and Poremski H. (1982) - Screening of the adsorption behaviour of new chemicals: natural soils and model adsorbents. Ecotoxicol Environ Saf, 6, 236
- Bouchard D. C., Mravik S. C. and Smith G. B. (1990) - Benzene and naphthalene sorption on soil contaminated with high molecular weight residual hydrocarbons from unleaded gasoline. Chemosphere, 21, 975
- Løkke H. (1984) - Sorption of selected organic pollutants in Danish soils. Ecotox Toxicol Environ Saf, 8, 395.
- Veith G. D., De Foe D. L. and Bergstedt B. V. (1979) - Measuring and estimating the bioconcentration factors of chemicals in fish. J Fish Res Board Can, 36, 1040-1048.
- Riley R. T., Mix M. C., Schaffer R. L. and Bunting D. L. (1981) - Uptake and accumulation of naphthalene by the oyster Ostrea edulis, in a flow-through system. Marine Biol, 61, 267-276
- Biodegradation and Bioaccumulation data of existing chemicals based on the CSCL. Chemicals Inspection and Testing Institute. Japan. (méthode OCDE 302 C, CITI, 1992)
- Delfino J. J. and Miles C. J. (1985) - Aerobic and anaerobic degradation of organic contaminants in Florida groundwater. Proc Soil Crop Sci Soc Fla, 44, 9-14.
- Nielsen P. H. and Christensen T. H. (1994) - Variability of biological degradation of aromatic hydrocarbons in an aerobic aquifer determined by laboratory batch experiments. J Contam Hydrol, 15, 305-320.
- Bauer J. E. and Capone D. G. (1985), Effects of four aromatic organic pollutants on microbial glucose metabolism and thymidine incorporation in marine sediments. Appl Environ Microbiol, 49, 828-835
- Delaune R. D., Hambrick G. A. and Patrick W. H. (1980) - Degradation of hydrocarbons in oxidised and reduced sediments. Mar Pollut Bull, 11, 103-106
- « Hydrocarbures Aromatiques Polycycliques (HAPs) : Évaluation de la relation dose-réponse pour des effets cancérigènes - Approche substance par substance (facteurs d’équivalence toxique – FET) et approche par mélange ; évaluation de la relation dose-réponse pour des effets non cancérigènes : Valeurs Toxicologiques de Référence (VTR) » de l'INERIS (Voir)
- Dawson J., Thayer W. and Desforges J. (1958) - Acute hemolytic anemia in the newborne infant due to naphtalene poising: Report of two 2 cases, with investigations into the mechanism of the disease. Blood, 13, 1113-1125
- Tingle M., Pirmohmed M. and Templeton E. (1993) - An investigation of the formation of cytotoxic, genotoxic, protein-reactive and stable metabolites from naphthalene by human liver microsomes. Biochem Pharmacol, 46 (9), 1529-1538.
- Calabrese E. J. (1986) - Ecogenetics: historical foundation and current status. J Occup Med, 28, 10, 1096-1102.
- /gesundheit/survey/publikationen/KUS-VOC-Innenraumluft-2008.pdf GerES (2008). Vergleichswerte für flüchtige organische Verbindungen (VOC und Aldehyde) in der Innenraumluft von Haushalten in Deutschland, Ergebnisse des repräsentativen Kinder-Umwelt- Surveys (KUS) des Umweltbundesamtes, Bundesgesundheitsblatt – Gesundheitsforschung – Gesundheitsschutz, 51: 109-112
- AVIS de l’Agence française de sécurité sanitaire de l’environnement et du travail Relatif à la proposition de valeur guide de qualité de l’air intérieur pour le naphtalène ; auto-Saisine Afsset (2004)]
- « Valeur Toxicologique de Référence »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), sur Anses - Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail, octobre 2014 (consulté en octobre 2014).
- Valeur guide de qualité de l’air intérieur, proposée par un projet financé par la commission européenne
 91,9×10-6 cm3·mol-1
91,9×10-6 cm3·mol-1








 1,582 2
1,582 2 