Chlorure de césium
Dans l'article d'aujourd'hui, nous allons approfondir le sujet de Chlorure de césium, une question qui a généré des débats et des controverses ces derniers temps. Chlorure de césium est un problème qui touche un large spectre de la société, depuis les professionnels de divers domaines jusqu'aux gens ordinaires qui sont confrontés à des défis liés à ce problème dans leur vie quotidienne. Dans cet article, nous explorerons différentes perspectives et approches liées à Chlorure de césium, dans le but de faire la lumière sur ses implications et d'offrir une vision globale de cette question. Quel que soit votre niveau d’expérience ou vos connaissances préalables sur Chlorure de césium, vous trouverez à travers cet article des informations pertinentes et précieuses qui vous permettront de mieux comprendre cette problématique et ses éventuelles implications dans divers domaines. Lisez la suite pour plonger dans le monde fascinant et complexe de Chlorure de césium !
| Chlorure de césium | |

| |
| Identification | |
|---|---|
| Nom UICPA | Chlorure de césium |
| No CAS | |
| No ECHA | 100.028.728 |
| No CE | 231-600-2 |
| PubChem | 24293 |
| SMILES | |
| InChI | |
| Apparence | cristaux blancs hygroscopiques |
| Propriétés chimiques | |
| Formule | CsCl |
| Masse molaire[1] | 168,358 ± 0,002 g/mol Cl 21,06 %, Cs 78,94 %, |
| Propriétés physiques | |
| T° fusion | 646 °C |
| T° ébullition | 1 382 °C |
| Solubilité | 1 860 g·l-1 à 20 °C |
| Masse volumique | 3,97 g·cm-3 |
| Cristallographie | |
| Système cristallin | cubique |
| Classe cristalline ou groupe d’espace | Pm3m, (no 221) |
| Strukturbericht | B2 |
| Structure type | CsCl |
| Composés apparentés | |
| Autres cations | Chlorure de lithium Chlorure de sodium Chlorure de potassium Chlorure de rubidium |
| Autres anions | Fluorure de césium Bromure de césium Iodure de césium |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
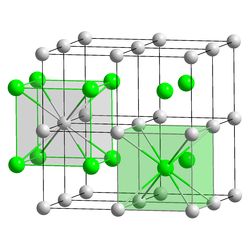
Le chlorure de césium est un composé chimique de formule brute CsCl. C'est un sel qui trouve de nombreuses applications comme source d'ions césium Cs+. Sa maille cristalline cubique est un exemple type en cristallographie.
Préparation
On prépare le chlorure de césium en faisant réagir de l'acide chlorhydrique HCl sur de l'hydroxyde de césium CsOH ou du carbonate de césium Cs2CO3 :
Structure
Le motif cristallin du chlorure de césium est cubique à base d'une paire d'ions Cs+ et Cl−. Le groupe d'espace est de type Pm3m, n° 221 ; la notation Strukturbericht est B2. Cette structure peut être décrite comme un réseau cubique d'ions Cs+ avec, au centre de chaque cube, un ion Cl− — ou réciproquement. Le bromure de césium CsBr et l'iodure de césium CsI partagent cette structure, ainsi que de nombreux composés intermétalliques : ce motif est observé lorsque les atomes ou les ions qui le constituent sont de taille voisine ; c'est ainsi le cas des ions Cs+ et Cl−, dont les rayons sont respectivement de 174 et 181 pm.
A contrario, lorsque les ions ou les atomes ont un diamètre différent, c'est la structure cubique à faces centrées qui prévaut, comme dans le cas typique du chlorure de sodium NaCl.

Applications
Le chlorure de césium est largement utilisé en centrifugation analytique dite isopycnique, correspondant à un gradient de densité à l'équilibre dans lequel les forces centrifuge et de diffusion permettent de séparer les mélanges en fonction de la densité moléculaire de leurs constituants, ce qui est très utile par exemple pour séparer des fragments de matériel génétique de masse volumique différente, tels que des brins d'ADN ayant des proportions différentes de paires A-T et G-C[2].
Le chlorure de césium contenant un ou plusieurs radioisotopes du césium sont utilisés en médecine nucléaire, y compris dans le traitement de certains cancers. Cette forme de césium radioactif est utilisée en radiothérapie externe bien que le chlorure de césium soit très soluble dans l'eau — et donc facilement dispersable dans l'environnement en cas d'incident — car aucune forme insoluble de césium ne permet d'atteindre une radioactivité suffisante par unité de volume pour être médicalement efficace.
Notes et références
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ (en) Manfred Bick et Horst Prinz « Cesium and Cesium Compounds » dans Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH, 2002, Weinheim.DOI 10.1002/14356007.a06_153.