Acide nitreux
Dans cet article, nous aborderons le sujet de Acide nitreux, qui a fait l'objet d'intérêt et de débats dans divers domaines. Acide nitreux a retenu l'attention des experts et du grand public en raison de sa pertinence et de son impact dans la société actuelle. Tout au long de l'histoire, Acide nitreux a joué un rôle fondamental dans différents aspects, que ce soit sur le plan social, culturel, technologique, politique, économique, entre autres. Dans cet article, nous explorerons les différentes dimensions et perspectives liées à Acide nitreux, dans le but de fournir une vision complète et enrichissante sur ce sujet.
| Acide nitreux | |
  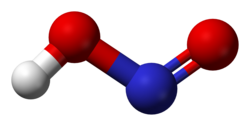 Structure de l'acide nitreux cis et trans. |
|
| Identification | |
|---|---|
| Nom UICPA | acide nitreux nitrite d'hydrogène |
| No CAS | |
| No ECHA | 100.029.057 |
| No CE | 231-963-7 |
| PubChem | 24529 |
| ChEBI | 25567 |
| SMILES | |
| InChI | |
| Apparence | solution bleu pâle |
| Propriétés chimiques | |
| Formule | HNO2 [Isomères] |
| Masse molaire[2] | 47,013 4 ± 0,000 9 g/mol H 2,14 %, N 29,79 %, O 68,06 %, |
| pKa | 3.35 à 25 °C |
| Moment dipolaire | 1,423 ± 0,005 D (cis) 1,855 ± 0,016 D (trans)[1] |
| Propriétés électroniques | |
| 1re énergie d'ionisation | ≤ 11,3 eV (gaz)[3] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L'acide nitreux (HONO) est un composé chimique de formule HNO2. C'est un monoacide faible que l'on ne connaît qu'en solution pas trop acide (il se dismute au pH bas), et en phase gazeuse. Ses sels (les nitrites) sont stables en solution aqueuse. L'acide nitreux est un des réactifs essentiels de la préparation des colorants azoïques et, dans l'air, le précurseur du radical hydroxyle (OH), l'un des principaux polluant de l'air, et une espèce chimique clé dans la formation des épisodes de pollution photochimique (c'est un puissant photo-oxydant).
En laboratoire, il et préparé in situ par acidification de nitrite de sodium à basse température (environ 5 °C).
La molécule HNO2 a été détectée dans le milieu interstellaire dans la composante B du système binaire IRAS 16293−2422 (en)[4].
Description
Son nom systématique est : acide dioxonitrique(III) ou acide nitrique III. Ses sels sont appelés nitrites.
Il est particulièrement instable et se dismute à température ordinaire en monoxyde d'azote NO et en ion nitrate −, ainsi que le montre le diagramme de Frost de l'azote donné ci-dessous :

L'azote, qui se trouve à l'état d'oxydation +III, se retrouve, après dismutation, aux états +V et +II.
L'acide nitreux est utilisé pour préparer des dérivés azoïques (azobenzène C6H5–N=N–C6H5) à partir d'amines aromatiques, par l'intermédiaire de sels de diazonium C6H5–N+≡N·X−.
Son pKa est de 3,3.
Polluant atmosphérique
C'est l'un des polluants photochimiques, acidifiant, de l'air créé par les apports d'engrais azotés, on le retrouve par exemple sur les cultures de maïs, à la suite de la réduction photo-induite du dioxyde d'azote (NO2)[5].
Stockage
On le prépare extemporanément, car il est trop instable pour être stocké, en ajoutant de l'acide chlorhydrique à du nitrite de sodium en solution :
Voir aussi
Notes et références
- ↑ (en) David R. Lide, Handbook of chemistry and physics, CRC, , 89e éd., 2736 p. (ISBN 142006679X et 978-1420066791), p. 9-50
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ (en) David R. Lide, Handbook of chemistry and physics, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- ↑ (en) A. Coutens, N. F. W. Ligterink, J.-C. Loison, V. Wakelam, H. Calcutt, M. N. Drozdovskaya, J. K. Jørgensen, H. S. P. Müller, E. F. van Dishoeck et S. F. Wampfler, « The ALMA-PILS survey: First detection of nitrous acid (HONO) in the interstellar medium », Astronomy & Astrophysics, vol. 623, , article no L13 (DOI 10.1051/0004-6361/201935040, Bibcode 2019A&A...623L..13C, arXiv 1903.03378, lire en ligne)
- ↑ « HONO-CORN : Production d'acide nitreux (HONO) sur le maïs par réduction photo-induite du dioxyde d'azote (NO2) », sur primequal.fr (consulté le )