Iodite
Dans le monde d'aujourd'hui, Iodite est devenu un sujet pertinent et intéressant pour des personnes de différents domaines et profils. Qu’ils soient chercheurs, professionnels, étudiants ou simplement curieux, Iodite a retenu l’attention et suscité des débats dans différents espaces. De son impact sur la société à ses implications mondiales, Iodite s'est avéré être un sujet qui mérite d'être exploré et analysé en profondeur. Dans cet article, nous approfondirons les différentes dimensions de Iodite pour comprendre son importance et ses répercussions sur notre réalité.
| Iodite | ||

| ||
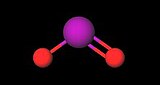 | ||
| Formule topologique (fig.1) et représentation 3D avec boules à 20% de la molécule d'iodite | ||
| Identification | ||
|---|---|---|
| Nom UICPA | iodite | |
| Nom systématique | dioxidoiodate(1−) | |
| No CAS | ||
| PubChem | 5460637 | |
| SMILES | ||
| InChI | ||
| Propriétés chimiques | ||
| Formule | IO2− | |
| Masse molaire | 58.90327 | |
| Composés apparentés | ||
| Autres anions | Chlorite | |
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
Un iodite est un sel de l'acide iodeux HIO2. L'ion iodite est l'anion IO2−. Dans ces sels comme dans l'ion, l'iode est à l'état d'oxydation +III.
Acide et sels
L'acide iodeux et les iodites, très instables, ont été observés[1] mais jamais isolés[2]. Ils se dissocient rapidement en molécules d'iode et d'iodate[1]. Ils ont aussi été détectés comme intermédiaires dans la conversion d'un iodure en iodate[3],[4].
Autres états d'oxydation
L'iode peut prendre les nombres d'oxydation −I, +I, +III, +V ou +VII. On connaît également un certain nombre d'oxydes d'iode neutres.
| Nombre d'oxydation de l'iode | −I | +I | +III | +V | +VII |
|---|---|---|---|---|---|
| Nom des sels ou de l'ion | Iodure | Hypoiodite | Iodite | Iodate | Periodate |
| Formule de l'ion | I− | IO− | IO2− | IO3− | IO4− ou IO65− |
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Iodite » (voir la liste des auteurs).
- (en) Norman N. Greenwood, Alan Earnshaw, Chemistry of the Elements, Butterworth-Heinemann, (ISBN 978-0-08-037941-8)
- ↑ R. C. Ropp, Encyclopedia of the alkaline earth compounds, Elsevier, (ISBN 978-0-444-59553-9 et 0-444-59553-8, OCLC 827243061, lire en ligne), p.93
- ↑ (en) Yugul Kishore Gupta et Devendra Nath Sharma, « Kinetics and mechanism of the reduction of iodate to iodite by bromide in the presence of phenol », The Journal of Physical Chemistry, vol. 75, no 16, 1971-08-xx, p. 2516–2522 (ISSN 0022-3654 et 1541-5740, DOI 10.1021/j100685a018, lire en ligne, consulté le )
- ↑ (en) Mary K. Gilles, Mark L. Polak et W. C. Lineberger, « Photoelectron spectroscopy of the halogen oxide anions FO − , ClO − , BrO − , IO − , OClO − , and OIO − », The Journal of Chemical Physics, vol. 96, no 11, 1992-06-xx, p. 8012–8020 (ISSN 0021-9606 et 1089-7690, DOI 10.1063/1.462352, lire en ligne, consulté le )